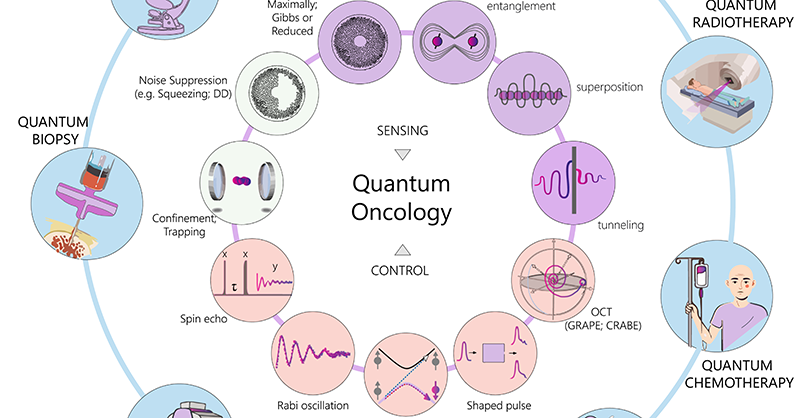
量子力学が切り拓くがん診療の未来
がんの診断と治療は著しい進歩を遂げてきました。その一方で、個別化医療、複雑な生物学的プロセスの理解、次世代シーケンシングで生成される膨大なマルチオミクスデータの計算処理などの課題にも直面しています。
これらの限界を克服するため、量子力学特有の特性(重ね合わせ、エンタングルメント、トンネル効果など)を活用する量子技術が、がん医療に革命をもたらす新たなフロンティアとして注目されています。これらの特性は、膨大なデータセットの処理や、生物学的プロセスの比類ない精度でのシミュレーションを可能にすると考えられます。
MDPIのジャーナル『Quantum Reports』に掲載された総説は、量子技術ががん医療に革新をもたらす可能性について網羅的に論じています。
量子の特性と応用の可能性
量子が同時に複数の異なる状態で存在しうるという「重ね合わせ」は、計算能力と微細な変化の検出能力を向上させます。「エンタングルメント」は、量子同士を距離を超えて結びつけ、ノイズを標準量子限界以下に抑えることで、より精密な量子測定を可能にします。「トンネル効果」は量子が通常の古典物理では通過できないような高いポテンシャルエネルギー領域を通過する現象で、がん研究においてさまざまな形で探究されています。たとえば、電子トンネリングはがんバイオマーカーの検出に用いるバイオセンサーの性能を向上させ、陽子トンネリングはがんの発生に関与するDNA変異の研究に寄与する可能性があります。これらの量子システムは、生体内の複雑な環境において、その高い感度を維持しつつ外部干渉に耐える精緻な制御が不可欠です。
診断における量子技術の可能性
イメージング:
MRIにおいては、量子スピン制御により磁場を微調整し、脳腫瘍や膵臓がんなどの微細な腫瘍特性の検出精度を高めます。CTスキャンでは、量子着想再構成アルゴリズムが解像度を20-30%向上させ、小さな結節の検出に貢献します。超音波イメージングでは、圧縮センシング技術により、甲状腺がんや皮膚がんの早期発見のための深い透過と優れた解像度が実現します。顕微鏡検査では、分子レベルでの可視化と特異性を向上させます。量子センサー(NVダイヤモンド、SQUID、SNSPDなど)は、これらのイメージング手法に統合され、感度と精度を大幅に向上させます。
生体組織および血液サンプル分析:
量子強化ロボット誘導と量子機械学習(QML)は、組織損傷を最小限に抑えつつ、最適な生検針経路をリアルタイムで計画します。量子センサーを搭載した生検ツールは、リアルタイムのバイオマーカー検出を可能にし、感度と速度を向上させます。機能化量子ナノ材料(量子ドット、NVダイヤモンドナノ粒子)は、イメージングコントラスト向上やがんバイオマーカー精密検出に貢献します。
バイオマーカー特定と検出:
量子制御技術は、生物学的プローブの量子状態を微調整し、DNA変異、RNAパターン、タンパク質、代謝産物などの正確な検出を可能にします。量子ドットは超高感度検出と複数バイオマーカーの同時識別に優れます。
オミクスアッセイとシーケンシング:
量子制御は、プロテオミクスやメタボロミクスにおける液滴生成の精度と効率を高め、Floquetスピン増幅や動的デカップリングは、遺伝子解析の信号対雑音比を向上させます。
量子AIと機械学習:
データ分析の精度と速度を向上させ、バイオマーカーや遺伝子変異の特定を加速します。
治療における量子技術の可能性
量子強化外科ツール:
量子強化レーザースカルペルは、完璧に同期された光子により、精密な腫瘍アブレーションと周囲組織への損傷最小化を実現します。高感度量子センサー搭載のロボットアームにより、低侵襲手術、回復期間短縮、腫瘍の完全除去が可能となります。
量子放射線療法:
量子エネルギービーム制御は、光子や陽子の量子状態を操作し、エネルギー送達精度を高めることで、腫瘍内の線量集中を最大化します。量子センサーによるリアルタイム監視は、腫瘍の動きに応じた適応放射線療法を可能にします。
量子化学療法とホルモン療法:
密度汎関数理論(DFT)などの量子化学技術は、分子相互作用シミュレーションを通じて薬物設計を最適化します。量子計算とQMLは、薬物設計における精度を飛躍的に高めます。量子制御技術は分子スピン状態を操作し、薬物の純度や結合親和性を向上させます。機能化量子ナノ材料は外部刺激に反応し、薬物送達精度を高めます。
量子免疫療法:
量子化学は、免疫チェックポイント阻害剤やCAR-T細胞療法などの生物学的製剤の設計を最適化し、効果を高めます。量子計算は遺伝子編集の精度向上に寄与します。機能化量子ナノ材料はスピン状態の精密制御により免疫調節を可能にします。
課題と今後の展望
量子腫瘍学の大きな可能性を現実のものとするためには、克服すべき重要な課題が存在します。
技術的課題:
臨床環境での量子コヒーレンス維持、生体適合性確保、量子デバイスのスケールアップが主な課題です。
運用の複雑性:
量子システムの導入は、医療従事者の専門訓練、既存ITインフラとの統合、高コスト、複雑な維持管理を伴います。
倫理・規制上の課題:
患者のプライバシー、データ所有権、アクセス格差、技術失敗時の責任といった倫理的・規制上の問題が浮上しています。
これらの課題を乗り越えるため、従来の機械学習と量子シミュレーションを組み合わせたハイブリッド量子-古典システムが有望視されています。創薬と治療計画を最適化できるAI駆動型量子プラットフォームの開発、物理学者、エンジニア、生物学者、腫瘍学者、計算科学者間の学際的協力、そして堅牢な規制と教育プログラムの確立が、今後の戦略的ロードマップの柱になると考えられます。